미FDA 약물안전성 보고서 어떤 약물이 포함됐나?
메디칼타임즈=원종혁 기자 다처방약제 대형품목들이 올해 마지막 의약품 안전성 평가보고서에 새로운 약물 부작용을 보고하면서, 안전성 평가 결과에 이목이 쏠릴 전망이다.
심혈관계 혜택을 검증한 당뇨병 주사제로 높은 시장 점유율을 보이고 있는 'GLP-1 수용체 계열' 약제부터, 위장병에 기본 약제로 처방되는 '프로톤펌프억제제(PPI)', 성인 편두통 표적치료제로 처방권에 진입한 'CGRP 항체의약품'까지 약물 이상반응 평가 대상에 이름을 올렸기 때문이다.
통상적으로 미국FDA의 안전성 평가 대상에 포함된 약제들의 경우, 추후 이상사례 조사결과에 따라 사용 제한조치 및 시장 퇴출까지 고려한다는 측면에서 귀추가 주목된다.
미국FDA가 올해 4분기 약물안전성 평가조사 보고서를 새롭게 업데이트해 공개했다. 해당 보고서에 이름을 올린 25개 약제 및 계열 약제들을 대상으로, 새롭게 보고된 잠재적인 이상반응과 함께 심각한 부작용 발생 정보에 대한 임상평가에 착수한다는 계획이다.
이번 FDA 이상사례보고시스템(FDA Adverse Event Reporting System, 이하 FAERS)이 발간한 보고서는, 올해 4월부터 6월까지 접수된 자료를 기준으로 이달 5일 최종 입장을 담았다.
특히 업데이트 보고서에 안전성 문제를 지적받은 품목에는 제2형 당뇨병 분야 대형 품목인 GLP-1 수용체 작용제 계열 약제들과, 위장관질환 분야 다처방약제인 프로톤펌프억제제(PPI)가 대거 포함됐다.
이에 따르면, GLP-1 계열약제 12개 품목에서는 잠재적인 이상반응으로 약물 사용에 따른 저혈당증이 문제로 지적됐으며, PPI 품목 11개의 경우 지난 분기에 이어 이번 분기에서도 저칼슘혈증 및 부갑상선호르몬(PTH) 장애에 대한 안전성 평가가 진행될 예정이다.
추후 안전성 평가 결과에 따라 추가적인 제제조치에 대한 입장도 내비쳤다. FDA는 보고서를 통해 "이번 평가결과는 잠재적인 이상신호들을 확인한 것으로, 추가적인 위험도 평가결과에 따라서는 제품의 라벨변화나 사용제한 조치, 시장 퇴출 명령 등을 포함한 제제 조치를 내릴 수 있다"고 밝혔다.
시장 첫 진입 편두통 표적신약부터 당뇨병, 위장약 대거 포함
세부사항을 살펴보면, 치료제 시장 대형품목으로 평가받는 CGRP 계열 편두통 표적 항체약품들과, 최근 당뇨병 분야 심혈관 혜택을 검증받으며 주요 옵션으로 등극한 GLP-1 작용제 계열약제들, 소화기질환분야 다처방약제인 프로톤펌프억제제(PPI) 계열약제들이 대거 포함됐다.
먼저 CGRP 계열약 중 에이모빅(에레뉴맙)은, 잠재적인 중증 이상반응 및 새로운 안전성 정보로 잘못된 근력(Wrong strength)이 포함됐다. 이에 대해 FDA는, 아직 추가적인 조치를 결정한 것은 아니지만 추후 안전성 평가 결과에 따라 해당 내용에 대한 제품 정보를 반영한다는 입장이다.
엠겔러티.
또한 '아조비(프레마네주맙)'와 '엠겔러티(갈카네주맙)', '바이앱티(Vyepti, 엡티네주맙)', 에이모빅 등 전체 CGRP 계열약들에선 약제나 병원미생물 감염 등 여러 가지 유발요인에 의해 일어나는 피부알레르기 질환인 '스티븐스존슨증후군(Stevens-Johnson syndrome)'이 안전성 이상신호로 지적됐다. 현재 당국은 제한조치를 내릴지 여부를 두고 안전성 평가를 진행 중인 상황으로 전했다.
당뇨병 치료제인 GLP-1 작용제 계열 역시 안전성 문제가 대거 지적을 받았다. 약물 사용으로 인한 저혈당증이 이상신호로 감지된 것.
여기엔 '릭시세나타이드'를 비롯한 릴리 둘라글루타이드(제품명 트루리시티)' 아스트라제네카 '엑세나타이드(제품명 바이듀리언, 바이에타 등)', 노보 노디스크의 '세마글루타이드(제품명 오젬픽, 리벨서스 등)', 리라글루타이드(제품명 삭센다 및 빅토자), 익시세나타이드와 인슐린 글라진 복합제인 '솔리쿠아', 알비글루타이드(제품명 탄제움), 리라글루타이드와 인슐린 데글루덱 복합제인 '줄토피' 등이 해당된다.
다처방 위장약인 프로톤펌프억제제(PPI) 계열약제들도 저칼슘혈증 및 부갑상선호르몬(PTH) 장애가 안전성 이상반응이 문제가 됐다. '에소메프라졸'을 비롯한 '라베프라졸' '란소프라졸' '오메프라졸' '판토프라졸' '에소메프라존 마그네슘' 등 오리지널 약들과 제네릭 약제들이 모두 해당됐다는 점이 주목할 부분이다.
유방암 및 전립선암, 혈액암 등 표적약 문제 "SMA 신약 졸겐스마 부작용 언급"
이밖에도 다수의 표적항암제들과 고지혈증 치료제, 지방간염 치료제, 척수성 근위축증 신약, 진통제 등에서도 안전성 문제가 제기됐다.
키스칼리.
유방암 분야 CDK4/6 계열 표적항암제인 노바티스 '키스칼리(리보시클립)'와 노바티스 '입랜스(팔보시클립)는, 피부알레르기질환인 스티븐스존슨증후군 이상신호가 보고되며 안전성 평가가 진행 중이다.
로슈의 다발성경화증 치료제 '오크레버스(오크렐리주맙)'에서는 투약한 인원에서 B형간염이 재활성화되는 이상신호가 새롭게 포착됐다.
전립선암 분야 항암제인 아스텔라스제약의 '엑스탄디(엔잘루타마이드)'가 중증피부유해반응(severe cutaneous adverse reactions, 이하 SCARs)이 안전성 정보에 업데이트됐다.
이와 관련 한국의약품안전관리원에 따르면, 약물에 의한 중증피부유해반응(SCARs)은 연간 발생률은 낮으나 발생 시 생명을 위협할 정도로 심각한 증상과 후유증을 남길 수 있는 중증의 과민반응에 속한다. 여기엔 '스티븐스-존슨 증후군(SJS)'과 '독성표피괴사용해(TEN)' '호산구증가와 전신반응을 동반한 약발진(Drug reaction with eosinophilia and systemic symptoms, 이하 DRESS)' 등이 대표적 이상반응으로 포함됐다.
이 밖에도 재발형 다발성 경화증의 재발 빈도 감소 및 장애 지연에 사용되는 사노피 '오바지오(테리플루노미드)'와 동일 성분을 함유한 제네릭 품목들에 대해선, 호산구증가증 및 전신반응에 대한 약물상호작용을 평가하고 있다.
다잘렉스.
또 다발골수종 피하주사제인 얀센 '다잘렉스(다라투무맙)'와 '다잘렉스 파스프로(다라투무맙/히알루로니다제-fihj)'는 리스테리아 모노키토게네스(Listeria monocytogenes )에 의해 전염되는 리스테리아병 관련 이상신호가 포착되며 제제조치를 평가하는 상황.
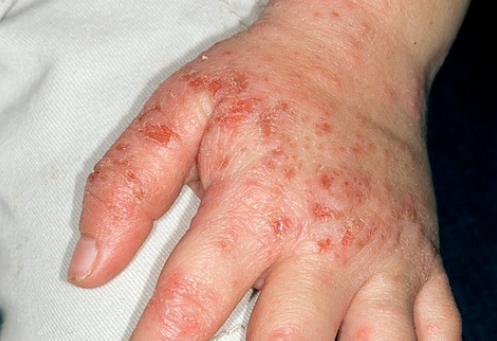
얀센 전립선암 치료제 '얼리다(아팔루타마이드)'는 대부분이 의약품에 의한 부작용으로 일어나는 피부점막장애 가운데 가장 중증에 해당하는 중독성표피박리증(toxic epidermal necrolysis, 이하 TEN)이 안전성 정보에 추가됐다.
로슈 유방암 표적항암제인 '캐드실라(아도-트라스투주맙 엠탄신)'는 모세혈관확장증 및 거미상혈관확장증 등 피부혈관장애(Skin vascular abnormalities)이 보고됐으나, FDA는 아직 제제조치에 대해서는 어떠한 결정도 내리지 않았다.
이상지질혈증 분야에 스타틴 병용 약제로 많이 사용된 '피브린산(fibric acid)' 계열 약제들도 대거 이름을 올렸다. 약물 사용에 따른 간손상 문제가 제기된 것인데, 품목으로는 페노피브레이트 성분의 '안타라' '리포펜' '페노글라이드' '트리글라이드' '트리코' 등과 페노피브린산 성분의 '피브로코', 콜린 페노피브레이트 등이 해당됐다.
더불어 이상지질혈증 치료제 분야 베스트셀링 품목인 화이자 '리피토(아토르바스타틴)'는 아토르바스타틴과 C형간염 바이러스(HCV)의 NS5A/NS5B 억제제와의 약물 상호작용에 대한 안전성 평가를 진행할 필요가 있다는 입증을 분명히 밝혔다.
비알코올성지방간염(NASH) 치료제인 '오칼리바(오베티콜릭산)'는 간장애 이상신호가 포착되면서 안전성 평가 자료제출이 요구될 상황이다.
졸겐스마.
노바티스의 척수성 근위축증(Spinal Muscular Atrophy, 이하 SMA) 치료신약인 '졸겐스마(onaseminal abeparvovec-xioi)'도 이번 안전성 평가목록에 추가됐는데, 새로운 안전성 평가로 혈전성 미세혈관병증(Thrombotic microangiopathy) 문제가 지적됐다. 여기서 혈전성 미세혈관병증은 혈소판 감소 및 미세혈관병성 용혈성 빈혈, 신경학적 증상과 신장 침범을 특징으로 하는 질환으로서 혈전혈소판감소자반증과 용혈요독증후군을 포함한다.
한편 하이드록시클로로퀸, 클로로퀸 등의 말라리아약 성분에서는 심독성(Cardiotoxicity) 문제가 지적되며 제제조치를 위한 안전성 평가가 진행중이다.
메타돈과 같이 아편중독에 의한 금단증상을 완화해 주는 효과가 있는 길항성 진통제인 '부프레놀핀(buprenorphine)'은 주사부위 괴사작용이, 에자이제약의 재발 이장성 다발성 경화증약 '티사브리(나탈리주맙)'가 신생아혈소판감소증(Neonatal thrombocytopenia)이 안전성 평가가 진행 중인 상황이라 결과에 따라 제품정보에 반영될지 귀추가 주목된다.